Назакаміяльная пнеўманія — найбольш распаўсюджаная і сур'ёзная назакаміяльная інфекцыя, з якой 40% складае штучная вентыляцыя лёгкіх (ШВЛ-асацыяваная пнеўманія). ШВЛ-асацыяваная пнеўманія, выкліканая рэфрактарнымі патагенамі, па-ранейшаму з'яўляецца складанай клінічнай праблемай. Гадамі ў рэкамендацыях рэкамендаваўся шэраг умяшанняў (напрыклад, мэтанакіраваная седацыя, пад'ём галавы) для прафілактыкі ШВЛ, але ШВЛ сустракаецца ў 40% пацыентаў з інтубацыяй трахеі, што прыводзіць да больш працяглага знаходжання ў стацыянары, павелічэння выкарыстання антыбіётыкаў і смерці. Людзі заўсёды шукаюць больш эфектыўныя прафілактычныя меры.
ШВЛ-асацыяваная пнеўманія (ШАП) — гэта новае захворванне, якое развіваецца праз 48 гадзін пасля інтубацыі трахеі і з'яўляецца найбольш распаўсюджанай і смяротнай назакаміяльнай інфекцыяй у аддзяленні інтэнсіўнай тэрапіі (АІТ). У рэкамендацыях Амерыканскага таварыства інфекцыйных захворванняў 2016 года ШАП адрозніваецца ад вызначэння бальнічнай пнеўманіі (ШП) (ШП адносіцца толькі да пнеўманіі, якая ўзнікае пасля шпіталізацыі без трахеальнай трубкі і не звязана са штучнай вентыляцыяй лёгкіх; ШАП — гэта пнеўманія пасля інтубацыі трахеі і штучнай вентыляцыі лёгкіх), а Еўрапейскае таварыства і Кітай лічаць, што ШАП усё яшчэ з'яўляецца асаблівым тыпам ШП [1-3].
У пацыентаў, якія знаходзяцца на штучнай вентыляцыі лёгкіх, частата выпадкаў ВАП вагаецца ад 9% да 27%, смяротнасць ацэньваецца ў 13%, і гэта можа прывесці да павелічэння сістэмнага выкарыстання антыбіётыкаў, працяглай штучнай вентыляцыі лёгкіх, працяглага знаходжання ў рэанімацыі і павелічэння выдаткаў [4-6]. ВПП/ВАП у пацыентаў без імунадэфіцыту звычайна выклікаецца бактэрыяльнай інфекцыяй, і размеркаванне распаўсюджаных патагенаў і характарыстыкі іх рэзістэнтнасці адрозніваюцца ў залежнасці ад рэгіёна, класа бальніцы, папуляцыі пацыентаў і ўздзеяння антыбіётыкаў, а таксама змяняюцца з цягам часу. Pseudomonas aeruginosa дамінавала сярод патагенаў, звязаных з ВАП, у Еўропе і Амерыцы, у той час як у трэціх бальніцах Кітая было выдзелена больш Acinetobacter baumannii. Ад траціны да паловы ўсіх смерцяў, звязаных з ВАП, непасрэдна выкліканы інфекцыяй, прычым смяротнасць выпадкаў, выкліканых Pseudomonas aeruginosa і Acinetobacter, вышэйшая [7,8].
З-за моцнай гетэрагеннасці ВАП дыягнастычная спецыфічнасць яе клінічных праяў, візуалізацыйных і лабараторных аналізаў нізкая, а дыяпазон дыферэнцыяльнай дыягностыкі шырокі, што ўскладняе своечасовую дыягностыку ВАП. У той жа час бактэрыяльная рэзістэнтнасць стварае сур'ёзную праблему для лячэння ВАП. Паводле ацэнак, рызыка развіцця ВАП складае 3%/дзень на працягу першых 5 дзён выкарыстання штучнай вентыляцыі лёгкіх, 2%/дзень паміж 5 і 10 днямі і 1%/дзень на працягу астатняга часу. Пік захворвання звычайна прыпадае на 7 дзён вентыляцыі, таму існуе акно, у якім інфекцыю можна прадухіліць на ранняй стадыі [9,10]. Шматлікія даследаванні разглядалі прафілактыку ВАП, але, нягледзячы на дзесяцігоддзі даследаванняў і спроб прадухіліць ВАП (напрыклад, пазбяганне інтубацыі, прадухіленне паўторнай інтубацыі, зніжэнне седацыі, падняцце галавы ложка на 30°-45° і догляд за паражніной рота), захворванне, відаць, не знізілася, і звязаная з гэтым медыцынская нагрузка застаецца вельмі высокай.
Інгаляцыйныя антыбіётыкі выкарыстоўваюцца для лячэння хранічных інфекцый дыхальных шляхоў з 1940-х гадоў. Паколькі яны могуць максымізаваць дастаўку лекаў да мэтавага месца інфекцыі (г.зн. дыхальных шляхоў) і зніжаць сістэмныя пабочныя эфекты, яны паказалі добрую каштоўнасць прымянення пры розных захворваннях. Інгаляцыйныя антыбіётыкі зараз зацверджаны Упраўленнем па кантролі за харчовымі прадуктамі і лекамі ЗША (FDA) і Еўрапейскім агенцтвам па лекавых сродках (EMA) для выкарыстання пры мукавісцыдозе. Інгаляцыйныя антыбіётыкі могуць значна знізіць бактэрыяльную нагрузку і частату абвастрэнняў пры бронхаэктазах без павелічэння агульнай колькасці пабочных эфектаў, і ў цяперашніх рэкамендацыях яны прызнаны прэпаратамі першай лініі для пацыентаў з інфекцыяй, выкліканай сінегнойнай палачкай, і частымі абвастрэннямі; Інгаляцыйныя антыбіётыкі ў перыаперацыйны перыяд трансплантацыі лёгкіх таксама могуць выкарыстоўвацца ў якасці дапаможных або прафілактычных прэпаратаў [11,12]. Але ў рэкамендацыях па VAP ЗША 2016 года эксперты не выказалі ўпэўненасці ў эфектыўнасці дапаможных інгаляцыйных антыбіётыкаў з-за адсутнасці буйных рандомізірованных кантраляваных даследаванняў. У даследаванні 3-й фазы (INHALE), апублікаваным у 2020 годзе, таксама не было атрымана станоўчых вынікаў (інгаляцыя амікацыну з унутрывенным увядзеннем антыбіётыкаў пры грам-адмоўных бактэрыяльных інфекцыях, выкліканых пацыентамі з ВАП, двайное сляпое, рандомізірованное, плацеба-кантраляванае даследаванне эфектыўнасці 3-й фазы, у агульнай складанасці 807 пацыентаў, сістэмнае ўвядзенне лекаў + інгаляцыя амікацыну на працягу 10 дзён).
У гэтым кантэксце каманда даследчыкаў з Рэгіянальнага універсітэцкага бальнічнага цэнтра Тура (CHRU) у Францыі прыняла іншую стратэгію даследавання і правяла ініцыяванае даследчыкамі шматцэнтравае двайное сляпое рандомізірованное кантраляванае даследаванне эфектыўнасці (AMIKINHAL). Інгаляцыйны амікацын або плацеба для прафілактыкі ВАП параўноўваліся ў 19 аддзяленнях інтэнсіўнай тэрапіі ў Францыі [13].
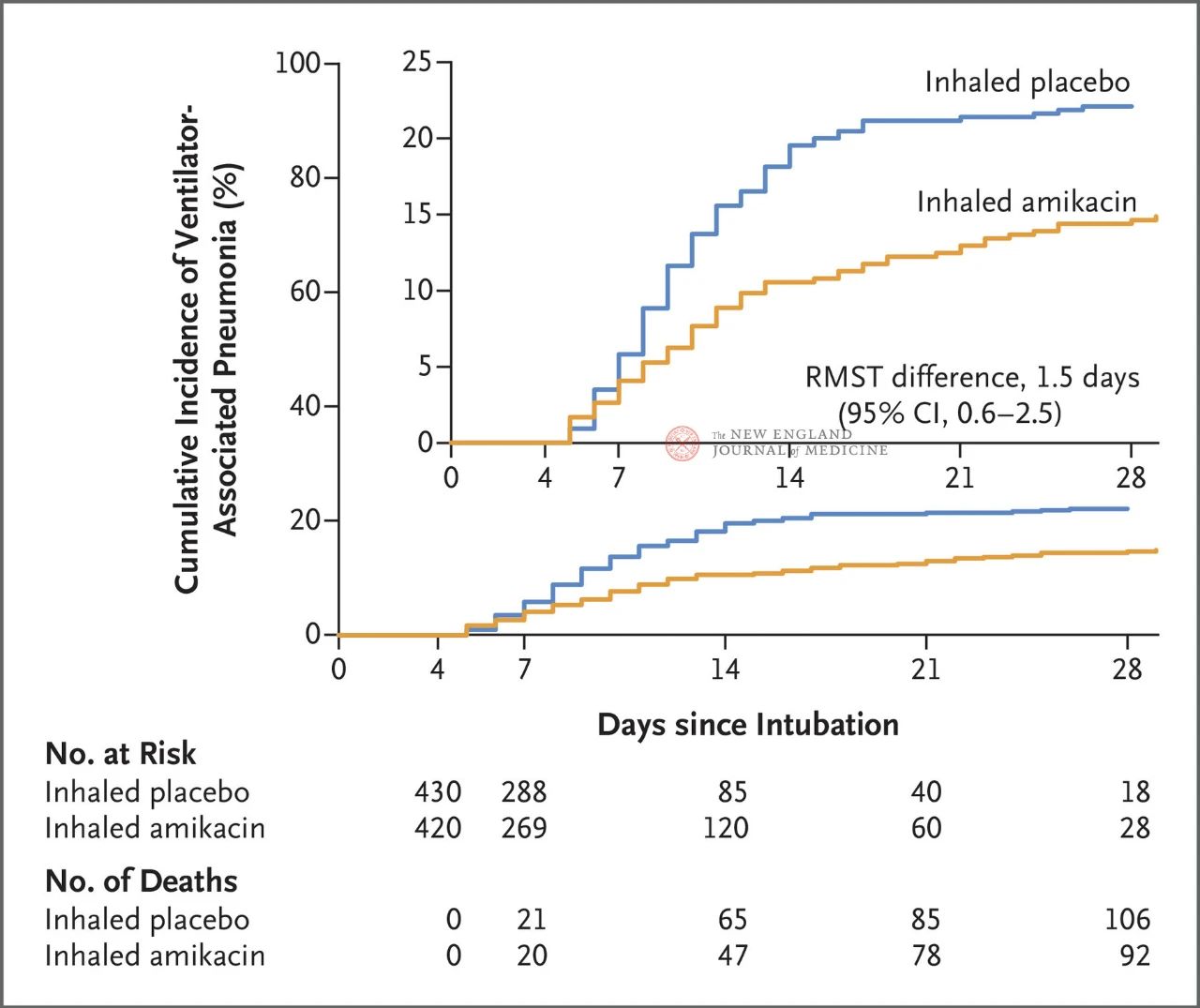
Усяго 847 дарослых пацыентаў з інвазівнай штучнай вентыляцыяй лёгкіх (ШВЛ) ад 72 да 96 гадзін былі выпадковым чынам размеркаваны ў суадносінах 1:1 для інгаляцый амікацыну (N = 417,20 мг/кг ідэальнай масы цела, адзін раз у дзень) або інгаляцый плацебо (N = 430, эквівалент 0,9% раствора хларыду натрыю) на працягу 3 дзён. Першаснай канчатковай кропкай быў першы эпізод ВАП з пачатку рандомізаванага размеркавання да 28-га дня.
Вынікі даследавання паказалі, што праз 28 дзён у 62 пацыентаў (15%) у групе амікацыну развілася ВАП, а ў 95 пацыентаў (22%) у групе плацеба — ВАП (абмежаваная сярэдняя розніца ў выжывальнасці для ВАП склала 1,5 дня; 95% ДІ, 0,6~2,5; P = 0,004).
Што тычыцца бяспекі, то ў сямі пацыентаў (1,7%) у групе амікацыну і ў чатырох пацыентаў (0,9%) у групе плацеба адбыліся сур'ёзныя пабочныя эфекты, звязаныя з выпрабаваннем. Сярод тых, у каго не было вострага пашкоджання нырак пры рандомізацыі, у 11 пацыентаў (4%) у групе амікацыну і ў 24 пацыентаў (8%) у групе плацеба вострае пашкоджанне нырак назіралася на 28-ы дзень (HR 0,47; 95% ДІ 0,23~0,96).
Клінічнае выпрабаванне мела тры асноўныя моманты. Па-першае, з пункту гледжання дызайну даследавання, выпрабаванне AMIKINHAL абапіраецца на выпрабаванне IASIS (рандомізірованное, двайное сляпое, плацеба-кантраляванае, паралельнае даследаванне фазы 2 з удзелам 143 пацыентаў). Для ацэнкі бяспекі і эфектыўнасці інгаляцый амікацыну-фосфаміцыну для сістэмнага лячэння грам-адмоўных бактэрыяльных інфекцый, выкліканых ВАП, і выпрабаванне INHALE, якое завяршылася адмоўнымі вынікамі, сканцэнтравана на прафілактыцы ВАП і атрымала адносна добрыя вынікі. З-за характарыстык высокай смяротнасці і працяглага знаходжання ў стацыянары ў пацыентаў на штучнай вентыляцыі лёгкіх і ВАП, калі інгаляцыі амікацыну могуць дасягнуць значна розных вынікаў у зніжэнні смяротнасці і знаходжання ў стацыянары ў гэтых пацыентаў, гэта будзе больш каштоўным для клінічнай практыкі. Аднак, улічваючы неаднароднасць позняга лячэння і догляду ў кожнага пацыента і ў кожным цэнтры, існуе шэраг змешваючых фактараў, якія могуць перашкодзіць даследаванню, таму таксама можа быць цяжка атрымаць станоўчы вынік, звязаны з інгаляцыяй антыбіётыкаў. Такім чынам, паспяховае клінічнае даследаванне патрабуе не толькі выдатнага дызайну даследавання, але і выбару адпаведных першасных канчатковых кропак.
Па-другое, хоць амінагліказідныя антыбіётыкі не рэкамендуюцца ў якасці асобнага прэпарата ў розных рэкамендацыях па ВАП, амінагліказідныя антыбіётыкі могуць ахопліваць распаўсюджаныя патагены ў пацыентаў з ВАП (у тым ліку сінегнойную палачку, ацынетобактэр і г.д.), і з-за іх абмежаванага ўсмоктвання ў эпітэліяльных клетках лёгкіх, высокай канцэнтрацыі ў месцы інфекцыі і нізкай сістэмнай таксічнасці. Амінагліказідныя антыбіётыкі шырока папулярныя сярод інгаляцыйных антыбіётыкаў. Гэтая праца адпавядае ўсебаковай ацэнцы памеру эфекту інтратрахеальнага ўвядзення гентаміцыну ў невялікіх выбарках, апублікаванай раней, якая сумесна дэманструе эфект інгаляцыйных амінагліказідных антыбіётыкаў у прафілактыцы ВАП. Варта таксама адзначыць, што большасць плацеба-кантроляў, адабраных у даследаваннях, звязаных з інгаляцыйнымі антыбіётыкамі, уяўляюць сабой нармальны фізіялагічны раствор. Аднак, улічваючы, што распыленая інгаляцыя звычайнага фізіялагічнага раствора сама па сабе можа гуляць пэўную ролю ў разрэджванні мокроты і дапамагаць адхарквальнаму дзейству, нармальны фізіялагічны раствор можа выклікаць пэўныя перашкоды ў аналізе вынікаў даследавання, што павінна быць усебакова ўлічана ў даследаванні.
Акрамя таго, важная лакальная адаптацыя лекаў HAP/VAP, а таксама антыбіётыкапрафілактыка. У той жа час, незалежна ад працягласці інтубацыі, экалогія мясцовага аддзялення інтэнсіўнай тэрапіі з'яўляецца найважнейшым фактарам рызыкі інфекцыі, выкліканай поліўстойлівымі бактэрыямі. Таму эмпірычнае лячэнне павінна максімальна абапірацца на мікрабіялагічныя дадзеныя мясцовых бальніц і не можа сляпа спасылацца на рэкамендацыі або вопыт трэціх бальніц. У той жа час крытычна хворыя пацыенты, якія патрабуюць штучнай вентыляцыі лёгкіх, часта маюць захворванні розных сістэм, і пад сумесным дзеяннем некалькіх фактараў, такіх як стрэсавы стан, можа назірацца таксама з'ява перакрыжаванага ўздзеяння кішачных мікробаў на лёгкія. Высокая гетэрагеннасць захворванняў, выкліканых унутранай і знешняй суперпазіцыяй, таксама вызначае, што маштабнае клінічнае прасоўванне кожнага новага ўмяшання - гэта доўгі шлях.
Час публікацыі: 02 снежня 2023 г.